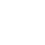2017年高考尖子生必做化學試題及答案
化學試題
相對原子質(zhì)量c-12、H-1、O-16、Cl-35.5、Br-79.9、Ca-40、I-127
選擇題(本題包括14小題,每小題4分,共56分)
1.若司機酒后駕車,可通過對其呼出的氣體進行檢驗而查出,所利用的化學反應如下:2CrO3(紅色)+3C2H5OH+3H2SO4Cr2(SO4)3(綠色)+3CH3CHO+6H2O。關于該反應,下列敘述不正確的是( )
A.1 mol CrO3發(fā)生氧化反應,轉移3 mol e-
B.C2H5OH是還原劑
C.CrO3在反應中表現(xiàn)氧化性
D.C2H5OH在反應中失去電子

3.鉈(Tl)與鋁同族。Tl3+在酸性溶液中能發(fā)生反應:Tl3++2AgTl++2Ag+下列推斷錯誤的是
A.Tl+的最外層有1個電子
B.Tl能形成+3價和+1價的化合物
C.酸性溶液中Tl3+比Tl+氧化性強
D.Tl+的還原性比Ag弱
4.根據(jù)如圖的轉化關系判斷下列說法不正確的是(反應條件已略去)( )
A.反應①②③④⑤均屬于氧化還原反應
B.反應⑤說明該條件下鋁可用于制熔點較高的金屬
C.相同條件下生成等量的O2,反應③和④轉移的電子數(shù)之比為1∶2
D.反應①中氧化劑與還原劑的物質(zhì)的量之比為1∶4
5.等質(zhì)量的氯氣與下列足量物質(zhì)反應,轉移的電子數(shù)最少的是( )
A.冷的NaOH溶液
B.SO2的水溶液
C.FeCl2溶液
D.銅
6.已知Cu2S與某濃度的硝酸反應時,生成硝酸銅和硫酸,若反應中Cu2S與HNO3的物質(zhì)的量之比為2∶13,則該反應的還原產(chǎn)物為( )
A.N2O
B.NO
C.NO2
D.N2O3
7.CuSO4溶液中加入過量KI溶液,產(chǎn)生白色CuI沉淀,溶液變棕色。向反應后溶液中通入過量SO2溶液變成無色。下列說法不正確的是( )
A.滴加KI溶液時,KI被氧化,CuI是還原產(chǎn)物
B.通入SO2后,溶液變無色,體現(xiàn)SO2的還原性
C.整個過程發(fā)生了復分解反應和氧化還原反應
D.上述實驗條件下,物質(zhì)的氧化性:Cu2+>I2>SO2
8.某反應體系中的物質(zhì)有NaOH、Au2O3、Na2S4O6、Au2O、H2O、Na2S2O3。Au2O3為反應物,則下列有關說法正確的是( )
A.該反應體系中有三種元素的價態(tài)發(fā)生了變化
B.Au2O在反應中作還原劑
C.Na2S2O3發(fā)生還原反應
D.1 mol Au2O3發(fā)生反應,轉移電子4 mol
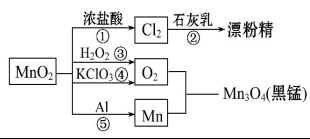
9.下列各裝置能夠達到相應實驗目的的是( )
A.用裝置甲除去乙酸乙酯中混有的少量乙酸
B.用裝置乙除去氯氣中的少量氯化氫
C.用裝置丙制取無水MgCl2
D.用裝置丁制取乙烯
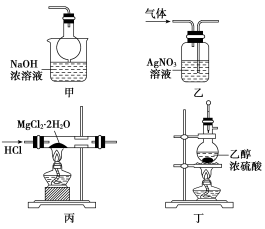
10.下列有關實驗操作、現(xiàn)象和解釋或結論都正確的是( )
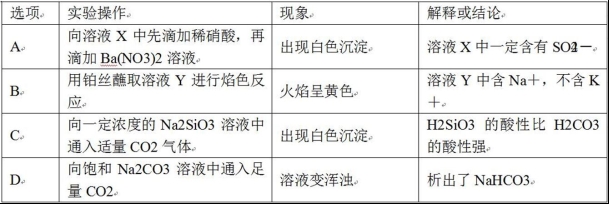
11.對于實驗Ⅰ~Ⅳ的描述正確的是( )
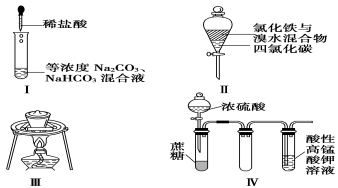
A.實驗Ⅰ:逐滴滴加稀鹽酸時,試管中立即產(chǎn)生大量氣泡
B.實驗Ⅱ:充分振蕩后靜置,下層溶液為橙紅色,上層無色
C.實驗Ⅲ:從飽和食鹽水中提取氯化鈉晶體
D.實驗Ⅳ:酸性KMnO4溶液中有氣泡出現(xiàn),且溶液顏色逐漸變淺乃至褪去
12.下列有機物命名及其一氯代物的同分異構體數(shù)目正確的是( )
| 命名 | 一氯代物 | |
| A | 2­甲基­2­乙基丙烷 | 4 |
| B | 1,3­二甲基苯 | 3 |
| C | 2,2,3­三甲基戊烷 | 6 |
| D | 2,3­二甲基­4­乙基己烷 | 7 |
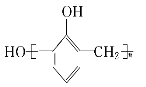 13.下列說法不正確的是( )
13.下列說法不正確的是( )
A.苯酚與甲醛在酸性條件下生成酚醛樹脂的結構簡式為
B.(NH4)2SO4和CuSO4溶液都能使蛋白質(zhì)沉淀析出
C.醋酸和硬脂酸互為同系物,C6H14和C9H20也一定互為同系物
D.迷迭香酸的結構為它可以發(fā)生酯化、水解、加成等反應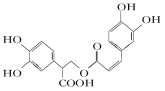
14.甲、乙、丙三種有機物的結構簡式如下圖所示,下列說法不正確的是( )
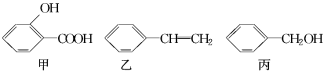
A.甲、乙、丙都能發(fā)生加成反應、取代反應
B.丙與C6H5OH都含有—OH,質(zhì)譜圖顯示的質(zhì)荷比最大值相差14,但不屬于同系物
C.淀粉、油脂、有機玻璃等都屬于高分子化合物
D.乙的化學名稱為苯乙烯,能使溴水褪色,但不存在順反異構體
二、必做題(本題包括2小題,共28分)
15(14分) 實驗室從含碘廢液中測定I-的含量以及碘的回收過程如下:
Ⅰ.含碘廢液中I-含量的測定
用移液管量取25.00mL廢液于250mL錐形瓶中,分別加入5mL2mol·L-1H2SO4溶液和10mL20% NH4Fe(SO4)2·12H2O溶液,搖勻,小火加熱蒸發(fā)至碘完全揮發(fā),取下錐形瓶冷卻后,加入10mL2mol·L-1 H2SO4溶液,加入幾滴二苯胺磺酸鈉(用作指示劑),用0.0250mol·L-1標準K2Cr2O7溶液進行滴定到終點。重復3次,數(shù)據(jù)記錄見下表:(已知反應①2Fe3++2I-===2Fe2++I2②6Fe2++Cr2O+14H+===6Fe3++2Cr3++7H2O)
| 次數(shù) | 1 | 2 | 3 |
| 滴定體積/mL | 19.60 | 19.65 | 19.55 |
Ⅱ.碘的回收
取250mL含碘廢液于燒杯中,加入Na2S2O3溶液,并將飽和CuSO4溶液在不斷攪拌下滴加到廢液中,加熱至70℃左右完全反應生成CuI沉淀。過濾,得到的CuI沉淀按圖1進行操作,檢查裝置的氣密性后,從分液漏斗中逐滴加濃硝酸(注意滴液的速度),完全反應后,通過減壓過濾,得到粗碘固體產(chǎn)品和抽濾液,然后按圖2進行粗碘的提純。
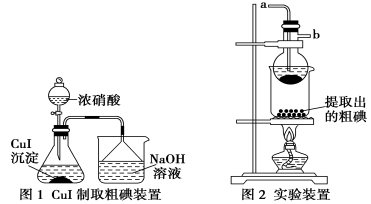
請回答下列問題:
(1)簡述圖2實驗裝置中燒瓶的作用_______________。
(2)某同學欲配制200mL2mol·L-1的H2SO4,配制方法合理的是________。
A.在200mL1mol·L-1的H2SO4中加入22.4L標準狀況下的SO3
B.向100mL4mol·L-1的H2SO4中加入100mL水
C.取5mol·L-1的H2SO4 80.0mL,加水至200mL
D.將16g NaOH固體加入到200mL3mol·L-1的H2SO4溶液中
(3)在盛有廢液的錐形瓶中先加入5mL 2mol·L-1H2SO4的目的是________。
(4)根據(jù)滴定的有關數(shù)據(jù),計算該廢液中I-的含量為______g·L-1。
(5)寫出圖1錐形瓶中發(fā)生反應的化學方程式_____________。
(6)按圖2裝置進行粗碘提純,采用的分離方法是________,a、b為冷凝水進出口,其中________(填“a”或“b”)接水龍頭,最終能得到較多較高純度的單質(zhì)碘。
16(14分)某校學生用如圖所示裝置進行實驗,以探究苯與溴發(fā)生反應的原理并分離提純反應的產(chǎn)物。
請回答下列問題: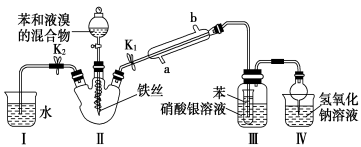
(1)冷凝管所起的作用為冷凝回流和________,冷凝水從________口進入(填“a”或“b”)。
(2)實驗開始時,關閉K2、開啟K1和分液漏斗活塞,滴加苯和液溴的混合液,反應開始。Ⅲ中小試管內(nèi)苯的作用是___________。
(3)能說明苯與液溴發(fā)生了取代反應的現(xiàn)象是_________
(4)反應結束后,要讓裝置I中的水倒吸入裝置Ⅱ中。這樣操作的目的是___________,簡述這一操作的方法______
(5)將三頸燒瓶內(nèi)反應后的液體依次進行下列實驗操作就可得到較純凈的溴苯。
①用蒸餾水洗滌,振蕩,分液;②用5%的NaOH溶液洗滌,振蕩,分液;
③再用蒸餾水洗滌,振蕩,分液;④加入無水CaCl2粉末干燥;⑤_____(填操作名稱)。
三.選擇題(任選一題)
17(16分)過氧化鈣可以用于改善地表水質(zhì)、處理含重金屬粒子廢水和治理赤潮,也可用于應急供氧等。實驗室可用工業(yè)碳酸鈣(含MgCO3、FeCO3等雜質(zhì))制取純凈的碳酸鈣,然后再用純的碳酸鈣制取過氧化鈣,其主要流程如下:
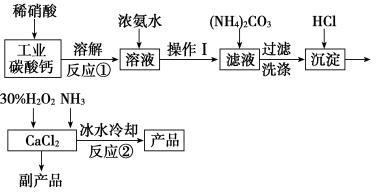
已知:CaO2·8H2O呈白色微溶于水,加熱至350℃左右開始分解放出氧氣,425℃分解完全。
(1)寫出反應①中氧化還原反應的離子方程式: ____________。
(2)向反應①后的溶液中加濃氨水的目的是: ________________。
(3)反應②生成CaO2·8H2O的化學反應方程式為_____________。
(4)反應②常用冰水控制溫度在0℃左右,其可能原因是(寫出兩種):
①________;②_________。
(5)測定產(chǎn)品中CaO2的含量的實驗步驟是
第一步:準確稱取a g產(chǎn)品于有塞錐形瓶中,加入適量蒸餾水和過量的b g KI晶體,再滴入少量2 mol/L的H2SO4溶液,充分反應。
第二步:向上述錐形瓶中加入幾滴淀粉溶液。
第三步:逐滴加入濃度為cmol·L-1的Na2S2O3溶液至反應完全,消耗Na2S2O3溶液VmL。已知:I2+2S2O===2I-+S4O。
①CaO2的質(zhì)量分數(shù)為_____________(用字母表示)。
②某同學第一步和第二步的操作都很規(guī)范,第三步滴速太慢,這樣測得的CaO2的質(zhì)量分數(shù)可能___(填“不受影響”“偏低”或“偏高”),原因是____________
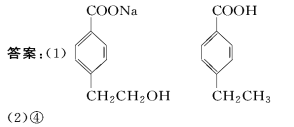
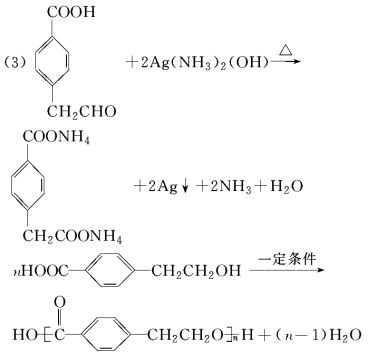
18(16分)有機物A~M有如圖所示轉化關系,A與F分子中所含碳原子數(shù)相同,且均能與NaHCO3溶液反應;F的分子式為C9H10O2,且不能使溴的CCl4溶液褪色;D能發(fā)生銀鏡反應;M與NaOH溶液反應后的產(chǎn)物,其一氯代物只有一種。
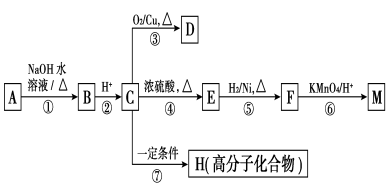
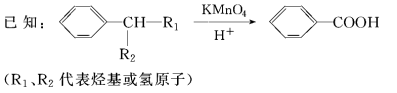
請回答:
(1)B、F的結構簡式分別為________、________。
(2)反應①~⑦中,屬于消去反應的是________(填反應序號)。
(3)D發(fā)生銀鏡反應的化學方程式為__________;反應⑦的化學方程式為____
(4)A的相對分子質(zhì)量在180~260之間,從以上轉化中不能確認A中的某一官能團,確定該官能團的實驗步驟和現(xiàn)象為________。
(5)符合下列條件的F的同分異構體共有________種。
a.能發(fā)生銀鏡反應
b.能與FeCl3溶液發(fā)生顯色反應
c.核磁共振氫譜上有四個峰,其峰面積之比為1∶1∶2∶6
化學答案
1.A2.C3.A4.D5.A6.A7.C8.D9.C10.D11.D12.D13.A14.C
15答案:(1)冷凝升化的碘單質(zhì),防止擴散到燒杯外
(2)C
(3)抑制Fe3+水解
(4)14.94
(5)2CuI+8HNO3===2Cu(NO3)2+4NO2↑+I2+4H2O
(6)升華、a
16.答案:(1)導氣、a (2)吸收溴蒸氣
(3)Ⅲ中硝酸銀溶液內(nèi)出現(xiàn)淡黃色沉淀(或測反應后Ⅲ中硝酸銀溶液的pH,其pH變小)
(4)反應結束后裝置Ⅱ中存在大量的溴化氫,使Ⅰ中的水倒吸入Ⅱ中可以除去溴化氫氣體,以免逸出污染空氣、關閉K1和分液漏斗活塞,開啟K2
(5)分餾(或蒸餾)
17.解析:(1)工業(yè)碳酸鈣中含有FeCO3、MgCO3等雜質(zhì),其中FeCO3中Fe為+2價,具有還原性,能和稀硝酸發(fā)生氧化還原反應。
(2)通過流程圖可知,加濃氨水用于調(diào)節(jié)溶液的pH,除去Mg2+、Fe3+。
(5)①測定實驗過程中發(fā)生如下反應:

18.
(4)取反應①后的混合液少許,向其中加入稀硝酸至酸性,滴加AgNO3溶液,若生成白色沉淀,則A中含氯原子;若生成淺黃色沉淀,則A中含溴原子
(5)2